La sclerosi laterale amiotrofica (SLA) e il microbiota
La sclerosi laterale amiotrofica o SLA è una malattia neurodegenerativa con degenerazione dei neuroni motori centrali e periferici, scopriamo insieme la correlazione col microbiota intestinale.
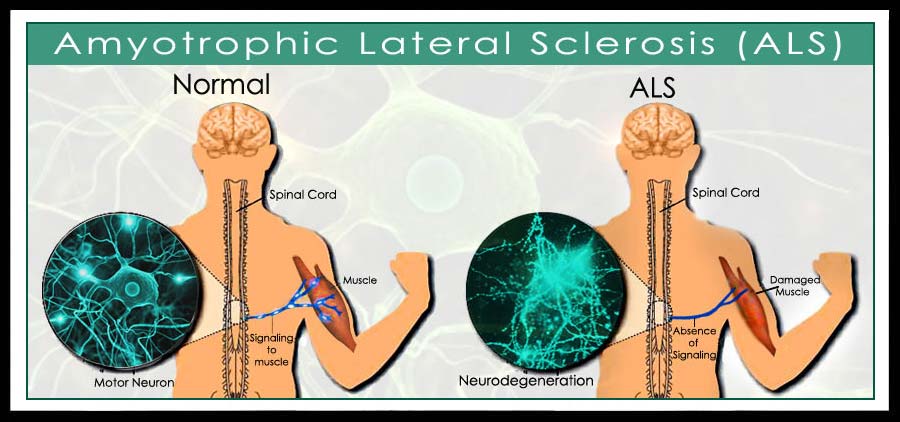
Il decorso della SLA è variabile da soggetto a soggetto ma riconosce come minimo comun denominatore la degenerazione dei neuroni motori e la conseguente paralisi progressiva che, negli stadi terminali, porta il soggetto alla morte per blocco dei muscoli respiratori.
Presenta un tasso di sopravvivenza medio di 3-5 anni dalla diagnosi.
La sclerosi laterale amiotrofica (SLA), alla pari della malattia di Alzheimer (AD) e del morbo di Parkinson (PD) è una malattia caratterizzata da proteine mal ripiegate e aggregate, e dall’infiammazione nel cervello.
In oltre il 90% dei casi, i medici e gli scienziati non sanno che cosa provoca l’insorgenza di questi processi.
L’eziologia non è chiara e la comunità scientifica è unanime nel ritenere che derivi da una compartecipazione di fattori genetici ed epigenetici.
Una mutazione nel gene C9orf72 è la variante genetica più comune che contribuisce allo sviluppo della sclerosi laterale amiotrofica (SLA).
Tuttavia, solo alcuni individui portatori della mutazione sviluppano la SLA.
Quindi, pur essendo una patologia geneticamente determinata, si ritiene che i fattori ambientali abbiano un ruolo nella progressione della malattia.
Il trattamento con l’unico farmaco approvato dalla FDA statunitense per l’uso nella SLA, il riluzolo, prolunga la durata della vita di un paziente di soli pochi mesi.
Pertanto, è necessario sviluppare nuovi interventi per alleviare la progressione della malattia e migliorare la qualità della vita nei pazienti con SLA.
Dati recenti suggeriscono che la disbiosi del microbiota intestinale può contribuire all’eziologia e alla progressione della SLA. Questo articolo si propone di esporre, in breve, alcuni dati sperimentali che mettono in relazione il microbiota intestinale e la fisiopatologia della SLA.

Studi effettuati sui topi
Un modello murino di sclerosi laterale amiotrofica utilizzato dai ricercatori è risultato caratterizzato da una maggiore permeabilità intestinale e da un’alterata composizione del microbiota, con una netta riduzione dei batteri che producono butirrato.
Tre lavori hanno fornito prove di cambiamenti nei profili dei microbioti nella SLA.
Due di questi studi sono stati condotti su modelli murini.
Un modello di topo SLA ha rivelato una struttura di giunzione stretta danneggiata e una maggiore permeabilità nell’intestino rispetto ai controlli insieme a un profilo del microbiota alterato, inclusi livelli ridotti di batteri produttori di butirrato.
In una pubblicazione successiva, utilizzando nuovamente un modello di topo SLA, i ricercatori hanno dimostrato che l’integrazione dietetica con butirrato ha alleviato i sintomi e prolungato il tempo di insorgenza della perdita di peso e il tempo di sopravvivenza.
Pertanto, questi studi forniscono una serie di prove che implicano il microbiota intestinale nella malattia di SLA, sebbene siano necessarie ulteriori ricerche per confermare la connessione e determinare i meccanismi fisiopatologici.
Prove emergenti hanno dimostrato che il microbiota intestinale svolge un ruolo essenziale nella patogenesi delle malattie umane negli organi distali; la disfunzione intestinale e la disbiosi possono contribuire attivamente alla fisiopatologia della SLA.
Alcuni studi hanno dimostrato come in cavie murine la presenza o l’assenza di determinati ceppi nel microbiota intestinale possa modulare positivamente o negativamente la progressione di una condizione simile alla SLA negli umani ed hanno identificato specifici microbi commensali associati alla gravità della malattia.
Inoltre, sono state riscontrate alterazioni nella composizione del microbiota prima che compaiano i sintomi della disfunzione dei motoneuroni.
La caratterizzazione del microbiota è stata molto precisa e ha portato ad osservare come esistano alcune specie batteriche in grado di esacerbare la progressione della malattia, mentre l’abbondanza di altre, come Akkermansia muciniphila, si riduce durante la progressione della malattia, mentre ceppi quali Ruminococcus torques e Parabacteroides distasonis aumentano nei campioni fecali: da qui l’ipotesi che Akkermansia potesse in qualche modo ridurre la progressione della sintomatologia.
È stato dimostrato che integrando i livelli di A. muciniphila si migliorano i sintomi della malattia e si prolunga la sopravvivenza nel modello murino di sclerosi laterale amiotrofica.
Inoltre, la nicotinamide è stata identificata come il metabolita prodotto da questo batterio che con maggiore probabilità è responsabile di questi effetti benefici. I ricercatori hanno continuato a sondare i meccanismi con cui il batterio e il metabolita modulano la progressione della sclerosi laterale amiotrofica e hanno individuato un numero di geni che sono risultati alterati nella loro espressione dalla A. muciniphila o dalla nicotinamide.
Studi effettuati sull’uomo
In un piccolo studio su pazienti affetti da SLA e controlli sani, i ricercatori hanno anche riscontrato livelli ridotti di batteri produttori di butirrato, essenziale per mantenere l’integrità della barriera intestinale, il butirrato è la fonte di energia preferita delle cellule epiteliali intestinali.
Recenti studi preclinici suggeriscono che la disfunzione del tratto gastrointestinale può svolgere un ruolo nella patogenesi della sclerosi laterale amiotrofica (SLA) attraverso una modifica dell’asse cerebrale del microbiota intestinale.
Robert P. Friedland, Professore Ordinario di Neurologia all’Università di Louisville, e un team di ricercatori, hanno studiato come questi processi possano essere innescati da proteine prodotte da batteri nel nostro intestino.
La loro ricerca ha rivelato che l’esposizione alle proteine batteriche (chiamate amiloide), che hanno una somiglianza strutturale con le corrispondenti proteine cerebrali, porta ad un aumento dell’aggregazione della proteina alfa-sinucleina nel cervello.
Aggregati di α-sinucleina mal ripiegata e le relative proteine amiloidi sono visibili nel cervello dei pazienti con malattie neurodegenerative tra le quali la SLA.
L´α-sinucleina (AS) è una proteina prodotta di norma dai neuroni del cervello.
Friedland ha ipotizzato come le proteine raggruppate simili, prodotte dai batteri nell’intestino, inducono le proteine cerebrali a ripiegarsi male tramite un meccanismo che porta alla deposizione di proteine cerebrali aggregate.
Ha anche proposto come le proteine amiloidi prodotte dal microbiota possano causare l’attivazione delle cellule immunitarie nell’intestino, con il risultato di una maggiore infiammazione nel cervello.
Eran Elinav e colleghi del Weizmann Institute of Science, hanno condotto uno studio preliminare su esseri umani, composto da un campione relativamente scarso (circa 37 soggetti con SLA e 29 controlli parenti sani), ed hanno osservato dei cambiamenti nella composizione dei microbi intestinali e ridotti livelli di nicotinamide come negli studi murini sopra riportati, saggiando la presenza di ceppi di Akkermansia in campioni di feci e di nicotinamide in campioni di sangue e liquido cefalo-rachidiano.
Con grande sorpresa, nei pazienti con SLA i livelli di nicotinammide erano diminuiti rispetto ai parenti sani, stessa cosa per i ceppi di Akkermansia molto più rappresentati nei parenti sani che nei pazienti malati.
Un piccolo studio pilota ha rilevato una ridotta diversità microbica in cinque pazienti con SLA caratterizzati da infiammazione intestinale, basso rapporto Firmicutes/Bacteroidetes e bassi livelli di SCFA.
L´obiettivo dello studio era quello di studiare i principali gruppi microbici dell’intestino umano e la diversità microbica complessiva nella SLA e nei soggetti sani.
Inoltre è stata esaminata l’influenza di un trattamento con una batterioterapia specifica composta da ceppi di Lactobacillus (Lactobacillus fermentum, Lactobacillus delbrueckii, Lactobacillus plantarum, Lactobacillus salivarius) che agiscono sulla barriera gastrointestinale.
Sono stati arruolati 50 pazienti con SLA e 50 controlli sani, abbinati per sesso, età e origine.
Sono stati utilizzati campioni fecali per l’estrazione del DNA genomico totale.
Il confronto tra soggetti affetti da SLA e gruppo sano ha rivelato una variazione nella composizione microbica intestinale con una maggiore abbondanza di E. coli ed enterobatteri e una bassa abbondanza di lievito totale nei pazienti.
I risultati preliminari confermano che esiste una differenza nel profilo del microbiota nei pazienti con SLA.
Conclusioni
Vi sono molti studi particolarmente interessanti che hanno messo in evidenza un collegamento tra il microbiota umano e sclerosi multipla, morbo di Parkinson, malattia di Alzheimer e neuromielite ottica (una malattia che solitamente interessa gli occhi e il midollo spinale; un tempo era considerata una variante della sclerosi multipla).
Più controversi, invece, sembrano gli studi che mettono in relazione il microbiota intestinale con la SLA (sclerosi laterale amiotrofica).
La prova del coinvolgimento di un microbiota alterato nella SLA è fornita da numerosi studi che hanno riportato un dismicrobismo e una maggiore permeabilità intestinale nei modelli di topi e nei pazienti con SLA.
Se il microbioma intestinale influenza la SLA è controverso, e questo dovrebbe stimolare maggiormente gli studi sul ruolo funzionale del microbiota sia in modelli murini di SLA che nella malattia dell´uomo.
Molti degli studi presi in considerazione puntano l’attenzione sulla modulazione dell’infiammazione, in particolar modo da parte di quei microrganismi che sono in grado di produrre acidi grassi a catena corta.
Questi risultati umani preliminari non sono sufficienti per costituire una raccomandazione terapeutica e richiedono la convalida in una più ampia coorte prospettica di pazienti.
Tuttavia, i risultati combinati di topo e umani suggeriscono un potenziale ruolo del microbiota intestinale nella sclerosi laterale amiotrofica.
Una scoperta che potrebbe aprire la strada a future ricerche su nuovi bersagli terapeutici.
Inoltre, l’efficacia del butirrato nel ristabilire l’equilibrio intestinale e nel ritardare la progressione della malattia suggerisce la possibilità di individuare in questo composto una nuova opportunità terapeutica.
La nuova comprensione del ruolo potenziale dei batteri intestinali nelle patologie neuro-degenerative potrebbe portare i ricercatori ad avvicinarsi a scoprire i fattori responsabili della genesi di queste malattie e, infine, allo sviluppo di misure preventive e terapeutiche.
Fonti
- Blacher E., Stavros Bashiardes Elinav E. “Potential roles of gut microbiome and metabolites in modulating ALS in mice”Nature 2019; v 572, pp: 474–480.
- Mazzini L., Mogna L., De Marchi F., Amoruso A., Pane M. et al. “Ruolo potenziale del microbiota intestinale nella patogenesi della SLA e possibili nuove strategie terapeutiche” Journal of Clinical Gastroenterology. 2018; v 52, pp: 68-70.
- Wright M.L., Fournier C., Houser M.C., Tansey M., Glass J., Stover H.V. “Potential role of intestinal microbiome in ALS: a systematic review” Biol Res Nurs 2018; 20 (5): 513-521.
Giuseppe Chindemi





