Premessa
Oggi sappiamo che i microbi e i relativi microbiota influenzano il metabolismo, l’immunità e persino il comportamento.
Lyte ed Ernst, nel 1992, furono i primi a definire il campo di ricerca sull’endocrinologia microbica, dopo aver osservato che gli ormoni neuroendocrini indotti dallo stress potevano influenzare la crescita batterica.
Ulteriori ricerche di endocrinologia microbica portarono alla scoperta di recettori ormonali nei microrganismi e ipotizzarono che questi rappresentassero una forma di comunicazione intercellulare.
Ulteriori indizi sull’esistenza di un crosstalk tra batteri e sistema endocrino vennero dalla scoperta di una comunicazione ormonale tra microrganismi e loro ospiti.
Sebbene le vie precise della segnalazione ormonale del microbiota non siano ancora state decifrate, cambiamenti specifici nei livelli ormonali sono correlati alla presenza del microbiota intestinale.
Recenti studi hanno dimostrato una produzione di ormoni da parte del microbiota e la sua capacità di rispondere a quelli prodotti dall’ospite evidenziando un rapporto tra microbiota intestinale e ormoni sessuali.
Ormoni sessuali
Fisiologicamente gli ormoni sessuali vengono sintetizzati dagli apparati riproduttori maschile e femminile. Anche le ghiandole surrenali secernono ormoni sessuali oltre ad aldosterone (mineralcorticoide) e cortisolo (glucocorticoide), in particolare sintetizza androstenedione convertito poi a livello periferico in testosterone. Il testosterone a sua volta sarà convertito in estradiolo dall’enzima aromatasi nei tessuti periferici.
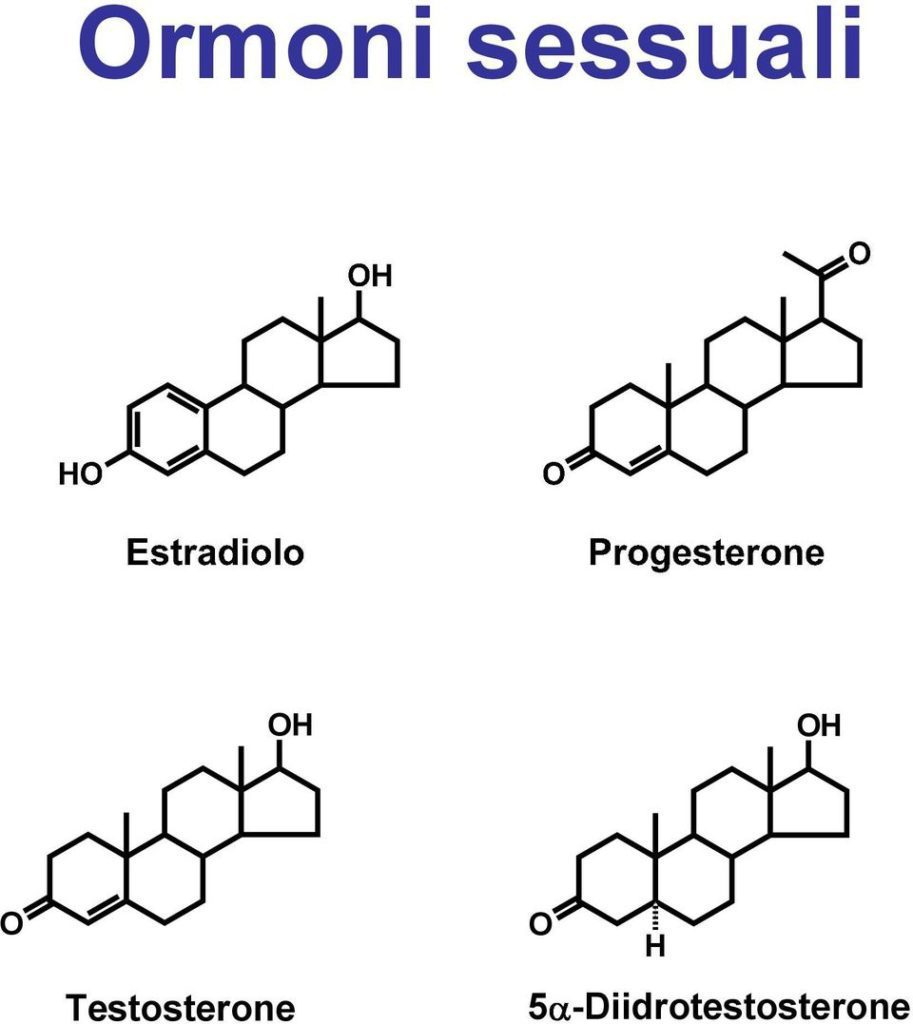
Gli ormoni sessuali come estradiolo (E2), testosterone (T) e progesterone (P4) modulano un gran numero di processi fisiologici collegati alla riproduzione ma non solo.
Prodotti da ghiandole endocrine, sono metabolizzati dal fegato ed escreti con la bile.
Molte di queste molecole sintetizzate dall’ospite sono chimicamente trasformate dal microbiota intestinale, ossia deconiugate ad opera di sulfatasi batteriche e glucuronidasi sintetizzate sia dalla parte dell´intestino che dai batteri.
Gli steroidi, esattamente come i sali biliari (molecole sintetizzate nel fegato a partire dal colesterolo e immagazzinati nella cistifellea), subiscono un ricircolo entero-epatico.
Nell’ecosistema intestinale i microbi hanno sviluppato enzimi per modificare alcuni acidi biliari e steroidi.
Un gran numero di specie possiedono enzimi coinvolti nella degradazione di steroidi non coniugati, come 21-idrossilasi, 17,20-desmolasi, 16 deidratasi e varie deidrogenasi (HSD).
Le deidrogenasi batteriche (HSD) possono influenzare la concentrazione di derivati attivi degli steroidi che tornano nel sangue mediante il ricircolo entero-epatico.
Diversi studi hanno dimostrato che il microbiota intestinale interviene nel metabolismo di estrogeni e androgeni, ad esempio, disbiosi intestinali possono causare un iperestrogenismo relativo.
Alcuni studi hanno correlato la disbiosi intestinale alla presenza di carcinomi mammari estrogeno sensibili così come di carcinomi della prostata.
Esempi di influenza dei batteri sugli ormoni sessuali sono stati riportati a partire dagli anni ’80. Ad esempio, Prevotella intermedius assume l´estradiolo ed il progesterone, che ne ottimizzano la sua crescita. Cambiamenti nell’espressione del recettore degli estrogeni ER-β, influenza anche la composizione del microbiota intestinale.
L’interazione riguarda anche la secrezione o la modifica di steroidi. Per esempio, Clostridium scindens converte i glucocorticoidi in androgeni, un gruppo di ormoni steroidei maschili.
I batteri intestinali svolgono anche un ruolo significativo nel metabolismo degli estrogeni, infatti l’uso di antibiotici ne limita il riassorbimento tramite il circolo entero-epatico, di cui la flora intestinale ne è passaggio fondamentale. Questo meccanismo risulta particolarmente importante in caso di assunzione di estroprogestinici (pillola anticoncezionale) in quanto potrebbe interferire con l’efficacia anticoncezionale.
Inoltre, sono state trovate forti correlazioni tra i livelli di estrogeni urinari e la ricchezza del microbioma fecale, così come la presenza di Clostridium, compresi i non-Clostridiales, e tre generi all’interno delle Ruminococcaceae.
Ormoni femminili
Gli ormoni sessuali sono in grado di modulare composizione, diversità e virulenza del microbiota. Ad esempio una dominanza di estrogeni rende la Candida più aggressiva. A sua volta il microbiota influenza i livelli ormonali e il loro metabolismo, si parla infatti di estroboloma.
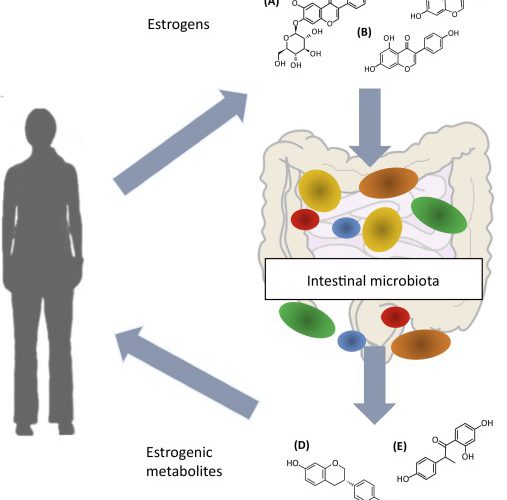
Lo stato ormonale regolato dal microbiota influenza l’immunità, questo aspetto potrebbe spiegare la prevalenza di malattie autoimmuni nei soggetti di sesso femminile. Il testosterone sembra avere un ruolo protettivo per le malattie autoimmuni.
L’estroboloma è l’insieme di batteri in grado di modulare il ricircolo enteroepatico di estrogeni e influenzare così i livelli circolanti di questi ormoni e la loro escrezione.
I batteri dell’estroboloma producono la β-glucuronidasi, un enzima che deconiuga gli estrogeni e li trasforma nella loro forma attiva, capace di legarsi ai recettori degli estrogeni e influenzare così i processi estrogeno dipendenti.
Una recente review, spiega il ruolo centrale del microbiota intestinale nella regolazione dei livelli di estrogeni circolanti e la sua influenza in malattie come endometriosi, sindrome dell´ovaio policistico (PCOS), cancro al seno e cancro della prostata.
Questi batteri normalmente comprendono una piccola proporzione del microbiota intestinale e consistono in specie del genere Clostridium.
Se siamo in situazione di eubiosi, l’estroboloma produce la giusta quantità di β-glucuronidasi e l’omeostasi degli estrogeni è mantenuta.
Se invece esiste una disbiosi intestinale, l’attività della β-glucuronidasi può essere alterata con conseguente carenza o eccesso di estrogeni liberi.
Gli estrogeni regolano i depositi di grasso e la differenziazione degli adipociti, il ciclo riproduttivo, il benessere cardiovascolare, il turnover delle ossa e la replicazione cellulare.
La disbiosi intestinale, quindi, altera l’estroboloma che a sua volta influenza negativamente l’omeostasi estrogenica, il metabolismo degli zuccheri e dei lipidi e apre la strada ad una serie di malattie croniche quali obesità, patologie cardiovascolari, osteoporosi, disturbi del ciclo, vaginiti, policistosi ovarica, endometriosi, disturbi cognitivi, ecc.
L’endometriosi, una condizione estrogeno-dipendente caratterizzata dalla crescita di tessuto endometriale al di fuori dell’utero, è associata alla disbiosi intestinale.
L’estroboloma della donna affetta da endometriosi è ricco di batteri produttori di β-glucuronidasi e questo porta ad un aumento degli estrogeni circolanti che a loro volta peggiorano l’infiammazione. In queste donne, oltre che nell´intestino, è stata riscontrata una disbiosi anche a livello vaginale ed endometriale, caratterizzata da riduzione dei lattobacilli e aumento di batteri gram-negativi potenzialmente patogeni, situazione che potrebbe ulteriormente aggravare lo squilibrio ormonale.
Alla luce di questi dati, il concetto di estroboloma dovrebbe essere esteso anche alla flora del tratto genitale.
Le donne affette da PCOS (sindrome dell´ovaio policistico) hanno un rapporto androgeni-estrogeni a favore dei primi e no è raro riscontrare anche una disbiosi intestinale, oltre ad una “sindrome da permeabilità intestinale”.
I ricercatori sono convinti che un’alterazione del microbiota nelle donne con PCOS promuova un eccesso di sintesi di androgeni e una contestuale riduzione di estrogeni, a causa di una ridotta attività β-glucuronidasica.
Di fatto, il trapianto di microbiota in modelli animali di PCOS ha ridotto la sintesi di androgeni e aumentato i cicli ovulatori, dimostrando come la modulazione dell’estroboloma possa essere vantaggiosa nella cura di questa malattia.
Numerosi studi hanno messo in evidenza un chiaro legame tra disbiosi intestinale e tumori. Nei pazienti oncologici spesso hanno un microbiota significativamente alterato rispetto ai pazienti sani.
Nel caso dei tumori della mammella e dell’endometrio, ad essere alterato è anche il microbiota dei tessuti stessi. In queste pazienti la disbiosi potrebbe essere la causa di un aumento cronico dei livelli circolanti di estrogeni, che poi legandosi ai recettori per questi ormoni causano la proliferazione cellulare nel caso di tessuti estrogeno-sensibili.
La popolazione microbica che risiede nell’intestino può influenzare il microbiota di tessuti distanti come la mammella, anche attraverso il trasferimento diretto di microbi: secondo alcuni studi, lattobacilli somministrati per bocca ad alcune pazienti sono poi stati ritrovati nei tessuti mammari intenti ad esercitare una possibile funzione antitumorale.
Appare chiaro che esiste una complessa relazione tra estroboloma, livelli di estrogeni, tessuti estrogeno-sensibili e tumorigenesi.
L’obesità, la PCOS e l’endometriosi sono situazioni che mettono le donne in una condizione sfavorevole per la fertilità.
Anche in questo caso un microbiota in salute migliora il profilo ormonale e metabolico. Si è visto che, la stessa metformina, farmaco usato in soggetti obesi e con PCOS, agisce anche sul microbiota aumentando la presenza di Akkermansia e modificandone la composizione
Ormoni maschili
Secondo le più recenti acquisizioni scientifiche sembra che ci sia più di una fonte di ormoni steroidei maschili nel corpo: e per essere precisi, alcuni batteri intestinali possono essere in grado di produrre ormoni steroidei maschili.
In un lavoro pubblicato sul Journal of Lipid Research, alcuni ricercatori hanno dimostrato che una specie batterica è in grado di converte i glucocorticoidi in androgeni, ormoni steroidei maschili.
I glucocorticoidi dell´ospite che entrano nell’intestino crasso sono metabolizzati da almeno un ceppo batterico isolato con attività acido biliare 7 α-deidrossilante.
L’isolato originale, un ceppo denominato “Clostridium 19”, aveva la capacità di tagliare la catena laterale dei 21α,17α-idrossiglucocorticoidi, convertendoli in androgeni C-19.
La varietà Clostridium 19 venne chiamata, in seguito, Clostridium scindens che significa “scindente” ossia “che taglia”.
Sono state studiate sia in vitro che in vivo le trasformazioni effettuate sugli acidi biliari dal batterio Clostridium scindens con attività 7 α– deidrossilante.
In vitro, Clostridium scindens mostra non solo capacità di 7α-disidrossilazione, ma anche capacità di ossidare altri gruppi idrossilici e ridurre i gruppi chetonici negli acidi biliari primari e secondari.
Questo studio ha rivelato l’acido 12-ossolitocolico come un importante prodotto transitorio nella 7-deidrossilazione di acido colico.
Inoltre, lo studio in vivo ha previsto la colonizzazione con Cl. scindens di una linea di topi gnotobiotici (privi della capacità di 7 α-deidrossilazione degli acidi biliari) studiando la sua trasformazione degli acidi biliari.
L’intestino crasso costituisce una nicchia per Cl. scindens, dove questo può modificare i glucocorticoidi e convertirli in androgeni.
Nell’intestino, gli steroidi androgeni possono essere ulteriormente modificati da altri membri del microbiota intestinale per produrre derivati del testosterone.
È quindi possibile che questi metaboliti steroidei interagiscano con i recettori nucleari dell’ospite o di altri organismi intestinali.
Nei maschi, ad esempio, la ghiandola prostatica è vicina alla parete del retto.
Pertanto, gli androgeni prodotti dai batteri intestinali sono in grado di passare passivamente con la possibilità di alterare la normale fisiologia delle cellule prostatiche
E questo potrebbe rappresentare uno dei meccanismi che spiegano la patogenesi dell’ipertrofia prostatica benigna, patologia che riguarda principalmente soggetti maschi di età avanzata.
L’implicazione del lavoro è che C. scindens potrebbe svolgere un ruolo importante nel sistema endocrino.
Conclusioni
Sebbene il campo della ricerca sul microbioma sia piuttosto recente e in via di sviluppo, un numero significativo di studi collega già ormoni e il microbiota intestinale.
Poiché il microbiota intestinale è in grado di produrre ormoni, non ci sono più dubbi: il microbiota intestinale può, a ragion veduta, essere considerato come un vero organo endocrino.
L’implicazione di tutto quanto riportato è che il sistema endocrino potrebbe non rappresentare l’unica fonte di ormoni sessuali e altre molecole regolatrici: il microbiota intestinale, infatti, potrebbe rappresentarne un´altra fonte.
Se è vero che alcuni batteri intestinali possono contribuire alla sintesi degli ormoni steroidei, si potrebbe iniziare a comprendere perché alcune malattie sono più frequenti in un sesso rispetto all’altro.
Ad esempio, malattie autoimmuni come l’artrite reumatoide, il lupus sistemico e la sclerosi multipla, hanno un’incidenza significativamente più elevata tra donne rispetto agli uomini.
Forse dipende dalle differenze nella composizione tra l’intestino di uomo e donna? Questa ipotesi è stata descritta, ma non dettagliata.
È possibile che alcuni batteri come ad esempio Clostridium scindens colonizzi preferibilmente l’intestino maschile rispetto a quello femminile.
Qualunque sia il significato di questo fenomeno, lasciamo che le risposte vengano dagli esperti.
Tutto questo ci porta a pensare che siano necessarie una medicina ed una nutrizione di genere.
La stessa risposta alle terapie e ai farmaci non è uniforme tra uomini e donne, e può essere spiegato dall’azione degli ormoni sessuali sul metabolismo epatico dei farmaci (citocromo P450).
Approcci integrati che coinvolgano lo stile di vita e le scelte alimentari avrebbero un potenziale di prevenzione, cura e/o supporto terapeutico altissimo data la centralità della salute intestinale e dell’equilibrio ormonale. È importante ricordare sempre che le modifiche dietetiche riescono a modulare il microbiota in pochi giorni e che questo rappresenta un potenziale terapeutico di grande rilievo.
Ricerche nel prossimo futuro identificheranno sicuramente vie dirette e/o indirette attraverso cui i batteri influenzano la produzione degli ormoni.
Classi specifiche di batteri (così come altri microrganismi tra cui archei, batteriofagi e virus infettanti eucarioti) avranno probabilmente ruoli regolatori nel controllare i livelli di produzione di ormoni dell´ospite.
Tutto questo potrebbe potenzialmente essere utilizzato in futuro per sviluppare nuovi trattamenti di patologie endocrine, disturbi autoimmuni collegati al genere o all’attività ormonale come perfino agli stati emotivi come lo stress.
Certo è che riuscendo a modulare il microbiota intestinale, disporremo di un importante potenziale per modificare i livelli ormonali, superare la depressione o lo stress assumendo una combinazione di “batteri buoni” attraverso dei preparati probiotici.
Anche se allo stato attuale questo sembra ancora fantascienza, questi nuovi approcci potrebbero diventare una piacevole realtà in pochi anni.
Tuttavia, al fine di convalidare tali approcci, i meccanismi, i ceppi batterici e l´azione di un “microbiota endocrino” dovranno essere completamente decifrati.
Fonti
- Kresser Criss “The Gut–Hormone Connection: How Gut Microbes Influence Estrogen Levels November 15, 2017 Kresser Institute.
- Neuman1 H., Debelius J.W., Knight R., Kore O. “Microbial endocrinology: the interplay between
- the microbiota and the endocrine system” FEMS Microbiology Reviews. 2015; 39, 509–521.
- Ridlon J.M. et al. “Clostridium scindens : a human gut microbe with a high potential to convert glucocorticoids into androgens Journal of Lipid Research. 2013; Volume 54, 20.
Giuseppe Chindemi





